Lásd a Cilest (Ethinylestradiolum, Norgestimatum) betegtájékoztatóját. Ellenőrizze a készítmény összetételét, felhasználását, adagolását és leírását. ÖSSZETÉTEL, A HATÁS LEÍRÁSA, JELZÉSEK, ELLENJAVALLATOK, AJÁNLOTT ÓVINTÉZKEDÉSEK, KAPCSOLAT EGYÉB KÁBÍTÓSZEREKKEL, ADAGOLÁSI ÉS ALKALMAZÁSI MÓDSZER, MELLÉKHATÁSOK.
Cilest BETEGTÁJÉKOZTATÓ
gyártó: Janssen-Cilag International N.V.
tabletták
Hatóanyagok: Etinilösztradiol, Norgestimate
ATC kód: G 03 A A 11
Szinonimák:
Etinilösztradiol Aethinyloestradiolum; Etinil-ösztradiol; Éthinylestradiol; Etinilösztradiol; Etinilösztradiol; Etinilösztradiol; Etinilestradiolis; Etinilöstradiol; Etinilösztradiol; Etinilösztradiol; Etinyyliestradioli; Etinilösztradiol-noresztimát-dexnorgestrel Acetime; Norgestimaatti; Norgestimate; Norgestimato; Norgestimatum
Javallatok: fogamzásgátlás
FIGYELEM! A betegtájékoztató a gyógyszer csomagolásában található. Információt tartalmaz a beteg számára a gyógyszer helyes használatáról.
Cilest®
tabletták
Fogalmazás
Egy tabletta a következőket tartalmazza:
0,250 mg Norgestimatum
0,035 mg Ethinyloestradiolum
Kiegészítő anyagok:
Vízmentes laktóz, módosított keményítő, magnézium-sztearát, indigókarmin-alumínium-tó.
A művelet leírása
A Cilest® gátolja a gonadotropinok szekrécióját az etinilösztradiol és a norgestimate ösztrogén és progesztációs hatása miatt. Az elsődleges hatásmechanizmus az ovuláció gátlása. A méhnyak nyálka és az endometrium tulajdonságainak változása szintén hozzájárulhat a fogamzásgátló hatáshoz.
Egyéb, a terhesség megelőzéséhez nem kapcsolódó tevékenységek.
Hatás a menstruációra: növeli a menstruációs ciklus szabályosságát, csökkenti a vérveszteséget és csökkenti a vashiányos vérszegénység előfordulását, csökkenti a dysmenorrhoea előfordulását.
Az ovuláció gátlásával kapcsolatos hatások: a funkcionális petefészek-ciszták előfordulásának csökkenése, a méhen kívüli terhességek előfordulásának csökkenése.
Egyéb akciók: a fibroadenomák, mastopathia, akut kismedencei gyulladásos megbetegedések előfordulásának csökkentése, az endometrium rák előfordulásának csökkentése, a petefészekrák előfordulásának csökkentése.
Jelzések
Orális fogamzásgátlás.
Ellenjavallatok
- Thrombophlebitis vagy más thromboemboliás rendellenességek
- Korábbi mélyvénás thrombophlebitis vagy más thromboemboliás rendellenességek
- Az agyi keringés vagy koszorúér-betegség zavarai
- Gócos aurájú migrén
- Ismert vagy feltételezett emlőrák
- Szövődményes szívbillentyű
- Súlyos magas vérnyomás (állandó szisztolés vérnyomás legalább 160 Hgmm, és a diasztolés vérnyomás legalább 100 Hgmm)
- Vaszkuláris szövődményekkel járó cukorbetegség
- Endometrium rák vagy más ismert vagy feltételezett ösztrogénfüggő neoplazma
- Nem diagnosztizált rendellenes hüvelyi vérzés
- sárgaság kolesztázis (kolesztatikus) miatt terhesség alatt vagy sárgaság, amelynek kórtörténetében orális fogamzásgátlót használtak
- Akut vagy krónikus májsejtek károsodott májfunkcióval
- Adenoma vagy májrák
- Terhesség vagy terhesség vélelme
- Terhes herpesz kórtörténete (a diagnózist a bőr biopsziája igazolja)
- Túlérzékenység a készítmény bármely összetevőjével szemben
Különleges figyelmeztetések és ajánlott óvintézkedések
Az orális fogamzásgátlók használatának kockázat-haszon arányának meghatározásakor ellenőrizni kell, hogy az alább felsorolt állapotok bármelyike növelheti-e az orális fogamzásgátlók használatával járó szövődmények kockázatát:
- Olyan rendellenességek, amelyek növelhetik a vénás thromboemboliás szövődmények kialakulásának kockázatát, például hosszan tartó immobilizáció vagy súlyos műtét
- Az artériás betegség kockázati tényezői, például dohányzás, megemelkedett szérum lipidszint (hiperlipidaemia), magas vérnyomás vagy elhízás
- Hipertónia (állandó szisztolés vérnyomás 140 és 159 Hgmm között, és a diasztolés vérnyomás 90 és 99 Hgmm között)
- Cukorbetegség
- Súlyos depresszió vagy anamnézisben súlyos depresszió
- Dohányzás
Tábornok
A szájon át alkalmazott fogamzásgátlók NEM védenek az emberi immunhiányos vírus (HIV) vagy bármely más nemi úton terjedő betegség ellen.
Az orális fogamzásgátló felírása előtt teljes kórtörténetet és fizikai vizsgálatot kell végezni. Az orvosi vizsgálatokat rendszeresen meg kell ismételni, az általánosan alkalmazandó szabályoknak megfelelően.
Javasoljuk, hogy ellenőrizze az orális fogamzásgátló felírását bemutató nő által szedett gyógyszereket. Ez vonatkozik a növényi készítményekre is (különösen az orbáncfű Hypericum perforatum). Kérjük, olvassa el az orális fogamzásgátlóval együtt alkalmazott gyógyszerek betegtájékoztatóit (lásd: Interakció más gyógyszerekkel).
Nem diagnosztizált, tartós vagy visszatérő hüvelyi vérzés esetén megfelelő vizsgálatokat kell végezni a rosszindulatú daganat jelenlétének kizárására.
Az orális fogamzásgátló legkorábban három hónappal azután használható, hogy a májfunkciós paraméterek normalizálódtak a hepatitis után. Súlyos hepatitis esetén ez az időszak nem lehet kevesebb, mint hat hónap.
Tromboembóliás rendellenességek és más érrendszeri rendellenességek
Az orális fogamzásgátlók alkalmazásával összefüggésben fennáll a tromboembóliás rendellenességek és a trombotikus rendellenességek fokozott kockázata. Az orális fogamzásgátlót használó nők relatív kockázata magasabb, mint azoknál a nőknél, akik nem szednek orális fogamzásgátlót: a felszíni vénás trombózis előfordulásának háromszorosa, a mélyvénás trombózis előfordulásának 4–11-szerese, ill. tüdőembólia és 1,5-6-szor olyan nőknél, akiknél a vénás tromboembólia kialakulására hajlamosak. Az orális fogamzásgátlók használatával járó tromboembólia kockázata nem függ alkalmazásuk időtartamától, és a készítmények szedésének befejezése után eltűnik.
Az orális fogamzásgátlót szedő nőknél a műtétet követően a tromboembóliás szövődmények relatív kockázata 2–4-szeresére nőtt. A vénás trombózis relatív kockázata kétszer magasabb azoknál a nőknél, akiknek hajlamos tényezőik vannak a fejlődésükre, mint az ilyen tényezők nélküli nőknél.
Ahol lehetséges, a tromboembólia kockázatával járó választható műtéteknél az orális fogamzásgátlók alkalmazását legalább négy hétig fel kell függeszteni a műtét előtt és két hétig, valamint a műtét utáni mozdulatlanság hosszan tartó ideje alatt. Sőt, a szülés utáni időszakban fokozott a tromboembóliás rendellenességek kialakulásának kockázata, ezért azoknál a nőknél, akik nem terveznek szoptatást, az orális fogamzásgátlókat legkorábban a szülés napjától számított 3 héten belül kell bevenni. A terhesség 20. hetében vagy azt követően végzett abortuszt követően orális fogamzásgátlók alkalmazhatók a vetélés után 21 nappal vagy az első spontán menstruációs vérzés első napján, attól függően, hogy melyik következik be előbb.
Az artériás trombózis (pl. Stroke, miokardiális infarktus) kialakulásának relatív kockázata nagyobb olyan hajlamosító tényezők jelenlétében, mint a dohányzás, a magas vérnyomás, az emelkedett szérum lipidszint (hiperlipidaemia), az elhízás, a cukorbetegség, a preeclampsia története és az idősebb kor . Ezek a súlyos érrendszeri szövődmények 50 mikrogramm vagy annál több ösztrogént tartalmazó orális fogamzásgátlók alkalmazásakor jelentkeztek. Az érrendszeri rendellenességek kockázata alacsonyabb lehet ösztrogént és progesztogént tartalmazó orális fogamzásgátló alacsonyabb dózisával.
A szív- és érrendszer súlyos mellékhatásainak kockázata az életkorral és az erős dohányzással növekszik. A kockázat jelentős a 35 év feletti, dohányzó nőknél. Az orális fogamzásgátlót használó nőknek azt kell javasolniuk, hogy hagyják abba a dohányzást.
Orális fogamzásgátlót szedő nőknél emelkedett vérnyomásról számoltak be. A vérnyomás emelkedése gyakoribb az idősebb nőknél és a hosszú távú fogamzásgátló felhasználóknál. Sok nő vérnyomása normalizálódott az orális fogamzásgátlók abbahagyása után. Nem volt különbség a magas vérnyomás előfordulása között azon nők csoportja között, akik korábban valaha orális fogamzásgátlókat használtak, és azon nők csoportja között, akik soha nem használtak orális fogamzásgátlót.
Artériás hipertóniában (szisztolés vérnyomás 140–159 Hgmm / diasztolés vérnyomás 90–99 Hgmm) szenvedő nőknél az orális fogamzásgátlók elkezdése előtt csökkentse a normális szintet, és ellenőrizze a vérnyomást. A vérnyomás jelentős emelkedése esetén az orális fogamzásgátlók alkalmazását fel kell függeszteni.
Orális fogamzásgátlók alkalmazásakor retina trombózisról számoltak be. Az orális fogamzásgátlókat fel kell függeszteni, ha megmagyarázhatatlan átmeneti részleges vagy teljes látásvesztés, homályos vagy kettős látás, makulaödéma vagy retina vaszkuláris elváltozások lépnek fel. Ilyen helyzetekben azonnal meg kell állapítani a rendellenességek okát, és megfelelő kezelést kell alkalmazni.
Májdaganatok
A jóindulatú és rosszindulatú májdaganatok (máj adenómák és hepatocelluláris karcinómák) előfordulási gyakorisága alacsony. Ezeknek a daganatoknak a kockázata nőhet az orális fogamzásgátlók használatának időtartamával és hosszával. A máj adenómáinak megrepedése végzetes lehet az intraabdominális vérzés miatt.
A reproduktív szervek és az emlő rákja
Azoknál a nőknél, akik jelenleg szednek orális fogamzásgátlókat, vagy akik az elmúlt 10 évben szedték őket, valamivel nagyobb az emlőrák diagnosztizálásának kockázata, de a rák diagnosztizálásakor ez általában a mellmirigyre korlátozódik. Az a kor, amelyben a nő abbahagyja az orális fogamzásgátlók szedését, fontos kockázati tényező az emlőrák kialakulásában. Minél később következik be az OC-k abbahagyásának kora, annál nagyobb a valószínűsége annak, hogy diagnosztizálják az emlőrákot. Az orális fogamzásgátló alkalmazásának időtartama ebben a tekintetben kevésbé volt fontos.
Egy nőnek mérlegelnie kell az emlőrák kialakulásának kockázatának növelésének lehetőségét az orális fogamzásgátlók használatának előnyeihez képest.
Az anyagcserére gyakorolt hatás
Az orális fogamzásgátlók csökkent glükóz toleranciát okozhatnak. Ez a hatás közvetlenül kapcsolódik az ösztrogén dózisához. A petefészek sárgatestje által a luteális fázisban termelt és kiválasztott szteroid női nemi hormonok (progesztogének) növelhetik az inzulin szekrécióját és szöveti rezisztenciát okozhatnak az inzulinnal szemben, amelynek súlyossága az alkalmazott progesztogén típusától függ. Egészséges (nem cukorbeteg) nőknél az orális fogamzásgátlók nincsenek hatással az éhomi szérum glükózra. Az orális fogamzásgátlók hatása miatt szorosan figyelemmel kell kísérni azokat a nőket, akik pre-diabetesben vagy diabetes mellitusban szednek orális fogamzásgátlót.
A szérum trigliceridek tartós növekedése (hipertrigliceridémia) az orális fogamzásgátlót használó nők kis százalékában fordul elő.
Fejfájás
Első alkalommal vagy a migrén súlyosbodása, vagy egy szokatlan, visszatérő, tartós vagy súlyos fejfájás esetén a COC alkalmazását abba kell hagyni, és meg kell vizsgálni a fejfájás okát.
Szabálytalan vérzés
Áttörő vérzés, foltosodás és / vagy vérzés hiánya fordulhat elő orális fogamzásgátlót használó nőknél, különösen a használat első három hónapjában. Határozza meg, van-e más oka ezeknek a rendellenességeknek, és ha szükséges, végezzen további vizsgálatokat a rák vagy a terhesség kizárására.
Néhány nő amenorrhea-t vagy ritka menstruációt tapasztalhat az orális fogamzásgátló alkalmazásának abbahagyása után, különösen akkor, ha a rendellenesség a COC-kezelés megkezdése előtt következett be.
A bőr foltos elszíneződése, főleg az arcon (chloasma)
Ritka esetekben chloasma fordulhat elő orális fogamzásgátlót szedő nőknél, különösen azoknál a nőknél, akiknél chloasma gravidarum volt. A kloasmára hajlamos nőknek kerülniük kell a napsugárzást vagy az ultraibolya sugárzást a készítmény szedése alatt. A chloasma gyakran nem teljesen oldódik a készítmény abbahagyása után.
Használja terhesség és szoptatás alatt
A Cilest® nem alkalmazható terhesség alatt.
Befolyásolja a gépjárművek vezetésének képességét, a gép működését és a pszichofizikai hatékonyságot
A Cilest® nincs hatással a járművek vezetésére és a mozgó mechanizmusok működtetésére.
Kölcsönhatás más gyógyszerekkel (kölcsönhatások).
Különböző gyógyszerek és növényi készítmények, köztük orbáncfű is befolyásolhatják az orális fogamzásgátlók metabolizmusát. A készítmény hatékonyságát jelentősen csökkentik azok a tényezők, amelyek növelik a hatóanyagok anyagcseréjét és kiválasztását. Ide tartoznak az ösztrogént metabolizáló enzimeket stimuláló tényezők, valamint az ösztrogének enterohepatikus keringését befolyásoló tényezők. Az orális fogamzásgátló ösztrogén komponensének csökkent hatékonysága foltozást, áttörő vérzést vagy fogamzásgátló kudarcot okozhat. Lehetséges, hogy ugyanazok az izoenzimek stimulálása a Cilest® progesztogén komponensének vérkoncentrációjának csökkenéséhez is vezethet. Azok a gyógyszerek és gyógynövénykészítmények, amelyekről ismert, hogy stimuláló hatást gyakorolnak az orális fogamzásgátlókban a szteroid hormonok lebontásáért felelős enzimekre (pl. Orbáncfű, barbiturátok, fenitoin-nátrium és különösen a rifampicin), klinikai jelentőségűek. Bizonyos proteázgátlók és bizonyos antiretrovirális szerek (pl. Indinavir) vagy csökkentik (pl. Ritonavir) a kombinált hormonális fogamzásgátlók hatóanyagainak vérszintjét.
Az interakciók másik típusa az ösztrogének enterohepatikus keringésének zavara, ami a hatóanyagok gyorsabb kiválasztódásához és az orális fogamzásgátlók hatékonyságának csökkenéséhez vezethet. Ilyen kölcsönhatás figyelhető meg például akkor, ha egy gyógyszert (pl. Kolesztiramint) epe-ösztrogén konjugátumokkal kombinálnak, vagy ha a konjugátumok bélbaktériumok általi lebontása káros (például bizonyos antibiotikumok - ampicillin vagy tetraciklin alkalmazása után).
A fogamzásgátló hatékonyság csökkenését találták a Cilest®, a rifampicin és az orbáncfű készítmények egyidejű alkalmazásával. Beszámoltak topiramáttal, barbiturátokkal, fenilbutazonnal, fenitoin-nátriummal, karbamazepinnel. Kölcsönhatás lehetséges a griseofulvinnal, ampicillinnel (troglitazon) és a tetraciklinekkel.
A Cilest® hatása a laboratóriumi vizsgálatok eredményeire
Az orális fogamzásgátlók zavarhatják az endokrin és a májfunkciós tesztek és a vérvizsgálatok néhány vizsgálatát:
- A protrombin és a II, VII, VIII, IX, X, XII és XIII faktor koncentrációjának növekedése; az antithrombin 3 koncentrációjának csökkenése; a noradrenalin által kiváltott vérlemezke-aggregáció fokozása.
- A pajzsmirigyhormon-kötő globulin (TBG) növekedése, ami a fehérje-kötött jód (PBI) és a tiroxin oszlopkromatográfiával vagy radioimmun-assay-val mérve mérhető teljes vérpajzsmirigyhormon-szintjének növekedéséhez vezet. A szabad trijód-tironin gyantafelvételének csökkenése, ami a TBG növekedésének felel meg. A szabad tiroxin koncentrációja változatlan marad.
- Más szérumkötő fehérjék koncentrációja növekedhet.
- A nemi hormont kötő globulin növekedése, ami a teljes nemi hormon szintjének emelkedéséhez vezet a vérben. Ennek ellenére a szabad, azaz biológiailag aktív hormonok koncentrációja vagy csökken, vagy változatlan marad.
- A nagy sűrűségű lipoprotein (HDL) koleszterin és az összkoleszterinszint növekedése előfordulhat. Az alacsony sűrűségű lipoprotein (LDL) koleszterinszint emelkedése vagy csökkenése előfordulhat az LDL-C / HDL-C arány és a változatlan trigliceridek csökkenésével. A felsorolt hatások az ösztrogén és a progesztogén dózisától és a progesztogén típusától függenek.
- A glükóz tolerancia romolhat.
- Az orális fogamzásgátlók alkalmazása során a szérum folsavszintje csökkenhet. Ennek klinikai jelentősége lehet, ha egy nő hamarosan teherbe esik az orális fogamzásgátlók abbahagyása után.
Adagolás és alkalmazás módja
Az orális fogamzásgátló készítmények hatékonysága
Pontosan az utasításoknak megfelelően, anélkül, hogy megfeledkezne a tablettákról, a teherbeesés esélye kevesebb, mint 1% (azaz kevesebb, mint 1 terhesség 100 nőből, akik egy évig használják a terméket). Az átlagos meghibásodási arány 5% a használat első évében. A teherbeesés valószínűsége nő az egyes ciklusok elmaradt tablettáival.
Felnőtteknél alkalmazható
A maximális fogamzásgátló hatékonyság elérése érdekében a Cilest® tablettákat pontosan az előírásnak megfelelően és a megfelelő sorrendben kell bevenni minden nap ugyanabban az időben, például lefekvés előtt. A tablettákat minden nap szünet nélkül vegye be az alábbiak szerint: Vegyen egy tablettát naponta egyszer vízzel, ugyanabban a napszakban 21 napig. Az utolsó tabletta bevétele után 7 napig nem szabad tablettát venni. Ha nem a gyógyszerét szedi, akkor vérzésre számíthat, általában 2–4 nappal az utolsó tabletta bevétele után. Ezen 7 napos időszak végén el kell kezdeni a Cilest® tabletták új ciklusát, még akkor is, ha a vérzés még nem kezdődött meg vagy nem fejeződött be.
Az alkalmazás első ciklusában az adagolást a menstruációs vérzés első napján kell elkezdeni (a fent leírtak szerint). A gyógyszert vízzel kell bevenni ugyanabban a napszakban, 21 napig. Az ajánlás szerint történő alkalmazás esetén a Cilest® fogamzásgátló hatást fejt ki a szedés első napjától kezdve, és a tabletta nem szedésének 7 napja alatt (a készítmény egymást követő csomagjai között).
Gyermekek
A Cilest® biztonságosságát és hatékonyságát fogamzóképes nőknél igazolták. A gyógyszert nem szabad használni a lányoknál a menstruáció kezdete előtt.
Idősek
Nem ajánlott nőknek a menopauza utáni időszakban.
A Cilest® alkalmazásának megkezdése olyan nőknél, akik korábban szedtek egy másik orális kombinált (ösztrogén-progesztogén) fogamzásgátlót.
Ha másik kombinált orális fogamzásgátló tablettáról vált, a Cilest® alkalmazását az előző ciklusban alkalmazott fogamzásgátló készítmény utolsó tablettájának bevételét követő 1-7 napon belül el kell kezdeni. A korábban használt készítmény utolsó tablettájának bevétele és a Cilest® első tabletta bevétele közötti időtartam nem lehet hosszabb 7 napnál. Ha az előző ciklusban az utolsó fogamzásgátló tabletta bevétele és a Cilest® első tabletta bevétele között 7 napnál hosszabb szünet áll fenn, hatékony, kiegészítő, nem hormonális fogamzásgátló módszert kell alkalmazni. Egy hétig kell használni, vagyis amíg hét Cilest® tablettát nem vett be.
A Cilest® alkalmazásának megkezdése olyan nőknél, akik korábban egy másik orális (csak progesztint tartalmazó) fogamzásgátlót szedtek.
A csak progesztogént tartalmazó fogamzásgátlóról történő váltáskor a Cilest®-t a korábban használt készítmény utolsó tablettájának bevételét követő első napon kell elkezdeni. Az első 7 nap során további nem hormonális fogamzásgátló módszert kell alkalmazni.
A Cilest® használata szülés után
Azok a nők, akik úgy döntöttek, hogy nem szoptatnak, a szülés után legkorábban 3 héttel kezdhetik el az orális fogamzásgátlók, köztük a Cilest® alkalmazását (lásd Thromboemboliás és egyéb érrendszeri rendellenességek és Terhesség és szoptatás). Ha úgy dönt, hogy a szülés után 21 nappal később kezdi el alkalmazni a Cilest®-et, orvosa eldöntheti, hogy az első 7 napban további, nem hormonális fogamzásgátló módszert kell-e alkalmazni a Cilest®-tel együtt, vagy várnia kell-e a Cilest® alkalmazásával a első menstruációs vérzés.
Vetélés után használja
A terhesség 20. hete előtti abortuszt követően az orális fogamzásgátlók azonnal elkezdhetők. Nem szükséges további fogamzásgátló módszert alkalmazni.
A terhesség 20. hetében vagy később történt vetélés után a hormonális fogamzásgátlók a vetélést követő 21. napon vagy az első spontán menstruációs vérzés első napján kezdhetők el, attól függően, hogy melyik következik be előbb. Nem hormonális fogamzásgátló módszert kell alkalmazni az első ciklus első 7 napján. Kivételes esetekben, amikor arra utaló jelek vannak, hogy a vetélés után azonnal elkezdjék a hatékony fogamzásgátló módszert, a Cilest®-et a vetélést követő első héten belül el kell kezdeni. Figyelembe kell venni a tromboembóliás rendellenességek fokozott kockázatát a vetélést közvetlenül követő időszakban.
Eljárás a megfelelő időben elmaradt tabletták esetén
Ha elfelejtette időben bevenni a tablettát (az egyes tabletták bevétele között legfeljebb 24 óra), vegye be a kihagyott tablettát, amint eszébe jut. A következő tablettát a tervezett időpontban vegye be. Ez azt jelenti, hogy két tabletta bevehető egy nap alatt.
Ha két tabletta hiányzik a ciklus első vagy második hetében, akkor két tablettát kell bevenni azon a napon, amikor az emlékeztetőre emlékeznek, és két tablettát kell bevenni a következő napon. Ezután vegyen be egy tablettát naponta az ajánlás szerint, amíg a csomagban lévő összes tablettát fel nem használja. Ezenkívül további, hatékony, nem hormonális fogamzásgátló módszert kell alkalmazni minden nap, amíg a hetedik tablettát egymás után beveszik.
Ha a készítmény használatának harmadik hetében két tablettát hagyott ki, ne vegyen be több tablettát ebből a csomagolásból, dobja el, és ugyanazon a napon kezdje el szedni a következő csomagot. Ezenkívül további, nem hormonális fogamzásgátló módszert kell alkalmazni minden nap, amíg a hetedik tablettát egymás után beveszik.
Ha a készítmény használatának első három hetében nem vett be három tablettát, ne vegyen be több tablettát ebből a csomagolásból, dobja el és kezdje el a tablettákat a következő csomagtól ugyanazon a napon venni. Ezenkívül további, nem hormonális fogamzásgátló módszert kell alkalmazni minden nap, amíg a hetedik tablettát egymás után beveszik.
Áttörő vérzés vagy foltosodás
Áttörő vérzés vagy foltosodás esetén a fogamzásgátlást folytatni kell. Áttörő vérzés nagyobb valószínűséggel fordul elő alacsony ösztrogént gátló termékek (ovuláció) alkalmazásakor. Ez a fajta vérzés gyakran több ciklus után leáll. Tartós intermenstruációs vérzés esetén forduljon nőgyógyászhoz.
Abban az esetben, ha a tabletta nélküli időszakban nincs vérzés (úgynevezett megvonási vérzés), a fogamzásgátló tablettát folytatni kell. Ha az orális fogamzásgátlót helyesen vették be, a vérzés hiánya a tabletta nélküli időszakban nem feltétlenül jelzi a terhességet. Ennek ellenére ki kell zárni a terhességet.
Tanácsok hányás esetén
Ha a tabletta bevételét követő 3 órán belül hányás jelentkezik, vagy ha a súlyos hasmenés 24 óránál tovább tart, a készítmény fogamzásgátló hatékonysága csökkenhet. Ha a hányás vagy a hasmenés gyorsan abbamarad, akkor a hatékony fogamzásgátlás mindaddig fennmarad, amíg a második Cilest® tablettát ugyanazon a napon beveszik. 24 órás vagy annál hosszabb ideig tartó hányás vagy hasmenés esetén a fogamzásgátló hatás csökkenhet, és további, nem hormonális fogamzásgátló módszert kell alkalmazni mindaddig, amíg hét tablettát szed egymás után (naponta).
Túladagolás
Az orális fogamzásgátlók túladagolásának életveszélyes tüneteit nem írták le. A túladagolás hányingert és hányást, lányoknál pedig hüvelyi vérzést okozhat. Nincsenek antidotumok, és a kezelésnek tüneti jellegűnek kell lennie.
Mellékhatások
A következő mellékhatásokat jelentették orális fogamzásgátlók alkalmazásakor (lásd Különleges figyelmeztetések és az alkalmazással kapcsolatos óvintézkedések).
- Szív- és érrendszer: artériás magas vérnyomás, miokardiális infarktus, agyi keringési rendellenességek, mélyvénás trombózis, artériás trombembólia, tüdőembólia és egyéb elzáródások.
- Daganatok: jóindulatú májdaganatok, rosszindulatú májdaganatok, méhnyakrák, emlőrák.
-Máj és epeutak: intrahepatikus kolesztázis (kolesztázis), epekövek.
- Egyéb: súlyos fejfájás, migrén, a látóideg károsodása.
Egyéb mellékhatások
- Szív- és érrendszer: enyhe vérnyomásemelkedés, ödéma.
- Reproduktív rendszer: áttöréses vérzés, foltosodás, amenorrhoea, elvonásos vérzés nincs, menstruációs vérzés változások, megnövekedett méh mióma, hüvelyi candidiasis, fokozott nyaki erózió és nyaki mirigy szekréció.
- Mell: érzékenység, galactorrhea, fájdalom, megnagyobbodás, a tej kiválasztásának csökkentése, ha közvetlenül a szülés után használják.
- Emésztőrendszer: hányinger, hányás, hasi görcsök, gáz, vastagbélgyulladás. Bőr: nodosum erythema, kiütés, chloasma, multiform erythema, pattanások, seborrhoea, alopecia, hirsutismus (hirsutismus, hypertrichosis), pemphigoid (gestációs herpesz), elszíneződés, amely a megvonás után nem tűnhet el, haemorrhagiás kitörések.
- Máj és epeutak: sárgaság kolesztázis (kolesztatikus), Budd-Chiari szindróma miatt.
- Szem: a szaruhártya görbületének megváltozása (maceráció), kontaktlencse-intolerancia, szürkehályog. Központi idegrendszer: fejfájás, hangulatváltozások, depresszió, ingerlékenység, chorea. Anyagcserezavarok: folyadékretenció, súlyváltozások (növekedés vagy csökkenés), csökkent glükóz tolerancia, étvágytalanság.
- Egyéb: változások a nemi vágyban (libidó), premenstruációs szindróma, átmeneti meddőség, átmenetiek a készítmény abbahagyása után.
- Húgyúti rendszer: veseműködési zavar, hemolitikus urémiás szindróma.
Tájékoztassa orvosát ezen vagy más mellékhatások előfordulásáról.
A lejárati idő után ne használja a készítményt
Tárolási módszer
Az eredeti csomagolásban tárolandó.
Legfeljebb 25 ° C-on tárolandó.
Gyermekektől elzárva tartandó.
Csomagok kaphatók
Közvetlen csomagolás
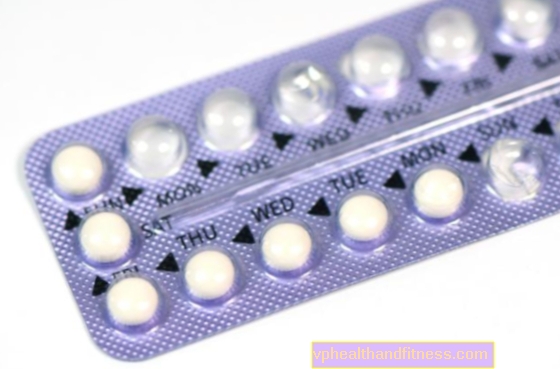
21 tablettát tartalmazó buborékfólia
Gyűjteményes csomagolás
A buborékfóliákat kartondobozokba csomagolják.
Egy doboz 1 vagy 3 buborékfólia Cilest® tablettát tartalmaz.
Felelős szervezet
Janssen - Cilag International NV
Turnhoutseweg 30
B - 2340 Beerse
Belgium
Az a gyártó, akivel együtt kiadják a gyógyszer tételét
Janssen Pharmaceutica NV
Turnhoutseweg 30
B - 2340 Beerse
Belgium
További részletekért forduljon a forgalomba hozatali engedély jogosultjának képviselőjéhez:
Janssen-Cilag Polska Sp. z o.o.
ul. Iłżecka 24
02-135 Varsó
A betegtájékoztató dátuma: 2007. október 3
FIGYELEM! A betegtájékoztató a gyógyszer csomagolásában található. Információt tartalmaz a beteg számára a gyógyszer helyes használatáról.